ТМС - современный метод картирования мозга, а также персонифицированной диагностики и лечения заболеваний нервной системы
Наши партнерыРоссийская академия наук
Институт медико-биологических проблем РАН
Лаборатория медицинских компьютерных систем МГУ им. Ломоносова
Медицинское оборудование Нейрософт
Производитель аппаратов ТМС - Magstim
Производитель навигационной ТМС - Nexstim
Электронный журнал "Асимметрия"
Медицинское оборудование и программное обеспечение - Neurobotics |
Терапевтические возможности ТМС
РИТМИЧЕСКАЯ ТРАНКСРАНИАЛЬНАЯ МАГНИТНАЯ СТИМУЛЯЦИЯ В ЛЕЧЕНИИ И РЕАБИЛИТАЦИИ ЗАБОЛЕВАНИЙ НЕВРНОЙ СИСТЕМЫ
Последние 10-20 лет в клиническую практику вошла новая технология ритмической ТМС (рТМС). Ритмическая транскраниальная магнитная стимуляция (рТМС) – вид стимуляции, при которой генерируется сразу серия импульсов, при этом частота импульсов может варьировать в пределах от 1 до 100 Гц. Разделяют два основных режима рТМС: низкочастотная и высокочастотная. При низкочастотной магнитной стимуляции происходило снижение возбудимости нейронов коры головного мозга, а при высокочастотной – повышение (Chen et al., 1999). Низкочастотная стимуляция определялась как стимуляция менее 1 Гц, высокочастотная – более 5 Гц. Также выделяют специальные «паттерные» режимы стимуляция, при которых стимулы располагаются не равномерно во время всей стимуляционной сессии, а в виде специфических кластеров (рис. 1).
Никочастотная стимуляция (< 1 Гц) приводит ингибиторному послеэффекту на зоны мозга, а высокочастотная стимуляция (> 5 Гц) в возбуждающему эффекту (Fitzgerald et al., 2006). Более того, продолжительность после эффекта пропорциональна продолжительности стимуляции, общему числу стимулов и кратности сессий (Robertson et al., 2006). Физиологический (терапевтический) эффект рТМС и длительное (до 3 месяцев) последействие традиционно связывается с изменением синаптической пластичности и метапластичности за счет феноменов LTP и LTD (Abraham, 2003).
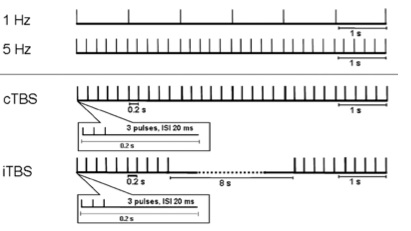
Рис. 1 Протоколы ритмической ТМС. 1 Гц и сTBS – ингибирующий режим; 5 Гц ( и выше) и iTBS – возбуждающие режимы.
В крупных рандомизированных, плацебо-контролируемых исследованиях доказана эффективность рТМС для большого числа патологических состояний и заболеваний: депрессия, обсессивно-компульсивные расстройства, болевые синдромы, мигрень, рефрактерные формы эпилепсии, тиннит, болезнь Паркинсона, дистонии, тремор, спастичность и др. рТМС рассматривается как эффективный метод нейрореабилитации у пациентов с последствиями поражения нервной системы (травма, инсульт).
В литературе, в увеличивается число публикаций, связанных с использованием рТМС в неврологии. Используется разные режимы, зоны мозга для стимуляции, длительность и кратность процедур. При этом получаемые данные носят весьма противоречивый характер.
Задачей данной публикации является освещение основных протоколов неинвазивной стимуляции мозга с помощью рТМС, обладающих наибольшей степенью доказанности. При написании использовались данные мета-анализов по использованию рТМС при заболеваниях нервной системы, протоколы крупных рандомизированных слепых плацебо-контролируемых исследований и Европейские руководства по безопасности и эффективности использования рТМС в неврологии (Lefaucheur J-P et al. 2014; Rossi et al., 2009).
Нейрореабилитация после нарушений мозгового кровообращен・.
Теоретическое обоснование использования неинвазивной стимуляции мозга при реабилитации после инсульта кроется в возможности этой методики изменять возбудимость отдельных регионов коры и функциональное взаимоотношение этих регионов. Как известно, после нарушений мозгового кровообращения в значительной мере меняется взаимоотношение зон M1, PMC, SMA двух полушарий. Изменяя возбудимость этих регионов коры, можно модулировать нейропластические процессы, происходящие после НМК. В нейровизуализационных и нейрофизиологических исследованиях доказано, что после инсульта происходит гиперактивация в противоположном очагу поражения полушарии, что приводит к ингибированию ипсилатерального полушария, через трансколозальные соединения, что является неблагоприятным для клинического восстановления (Ward, 2006).
В литературе обсуждается влияние неинвазивной стимуляции мозга на 3 основных симптома: моторный дефицит (гемипарез), афазия, пространственное игнорирование (неглект-синдром). Основной стратегией является увеличение возбудимости пораженного полушария и (или) снижение возбудимости непораженного полушария.
Моторный дефицит.
В базе данных PubMed насчитывается порядка 174 публикаций по изучению влияния рТМС на моторные функции после инсульта, в том числе 19 плацебо-контролируемых исследований и 3 мета-анализа (Hsu et al., 2012; Hao et al., 2013; Le et al., 2014), с общим обхватов около 500 пациентов. Основные режимы, применяемые в данных работах: низкочастотная стимуляция непоражённого полушария и высокочастотная – пораженного.
Одна из первых серьезных работ, показавших терапевтическую эффективность низкочастотной рТМС на моторные функции, была проведена в 2005 году (Mansur et al., 2005). Позднее появлялось большое число исследований, доказывающих эффективность низкочастотной рТМС в восстановлении моторных функций (Dafotakis et al., 2008; Nowak et al., 2008; Grefkes et al., 2010).
Некоторые исследования доказали эффективность высокочастотной стимуляции пораженного полушария при восстановлении моторных функций в острой и подострой стадиях инсульта. Данные эффекты опубликованы в работах Khedr et al. (2005, 2009, 2010).
Наконец, в одном исследовании была показана эффективность двусторонней стимуляции (1 Гц – непораженное полушарие; 10 Гц – пораженное полушарие) у пациентов в хронической стадии НМК. Показано достоверное улучшение моторных функций по шкалам Fugl-Meyer и Wolf Motor Function test и снижение спастичности по шкале Ашфорта (Yamada et al., 2013). Стоит отметить, что в Научном центре неврологии в настоящее время проводится открытое слепое плацебо-контролируемое исследование по эффективности ритмической стимуляции мозга у пациентов после инсульта. Согласно предварительным данным, высокочастотная стимуляция пораженного полушария более предпочтительна для снижения спастичности у пациентов, перенсесших инсульт; низкочастотная стимуляция достоверно улучшает моторные функции по шкале Fugl-Meyer, а стимуляция обоих полушарий приводит к увеличению повседневной жизненной актвиности по индексу Бартеля (Chervyakov et al., 2013; Piradov et al., 2013).
Дополнительные исследования показали, что рТМС имеет наилучший эффект при локализации очага ишемии в подкорковых образованиях, по сравнению корковыми очагами (Ameli et al., 2009; Emara et al., 2009). В единичных исследованиях показана эффективность высокочастотной рТМС моторных представительств глотки и пищевода для улучшения глотания (Khedr, 2010; Park et al., 2013).
Неясной остается ситуация с режимами стимуляции iTBS и cTBS. В публикациях найдены противоречивые данные. В одних работах, на небольшом количестве пациентов, показано, что использование режима iTBS на пораженное полушарие у пациентов после инсульта может улучшить моторные функции (Talelli et al., 2007, Ackerley et al., 2010, Hsu et al., 2013). С другой стороны, в контролируемом исследовании 41 пациента в хронической стадии инсульта ни режим iTBS на поражённое полушарие, ни режим cTBS на непораженное полушарие не привели к достоверным изменениям в моторных функциях у пациентов после НМК (Talelli et al., 2012).
Как отмечалось выше, многие из описанные выше исследований были включены в 3 мета-анализа, проведенных для уточнения характера эффекта ТМС на пациентов с НМК.
В мета-анализе, опубликованным в журнале Stroke (Hsu et al., 2012), и включившем 34 публикации (392 пациента), была показана достоверная эффективность рТМС на моторное восстановление в верхних конечностях у пациентов с инсультом. При этом низкочастотная стимуляция здорового полушария оказалась более эффективной, чем высокочастотная непораженного. Наилучший эффект рТМС достигался у пациентов с подкорковым инсультом, по сравнению с корковым очагом. Кроме того, доказана безопасность и эффективность применения режима iTBS на пораженное полушарие (Hsu et al., 2012).
Напротив, мета-анализ 2013 года (Hao et al., 2013), опубликованный в Кокрановской базе данных, свидетельствует об отсутствии достоверного эффекта как низкочастотной, так и высокочастотной стимуляции. Отсутствие эффекта выявлено по показателям индекса повседневной активности Бартеля и шкале ARAT (моторный дефицит). Обзор включил в свой состав 19 триалов, с общим числом пациентов 588 человек.
В последнем по этой тематике мета-анализе 2014 года, включившим 8 исследований с охватом 273 пациентов, показано, что рТМС (как высокочастотная, так и низкочастотная) достоверно улучшает функции руки и движения пальцев. Однако, при этом не происходит достоверных изменений в амплитуде вызванного моторного ответа и величине активного моторного порога.
Совокупность данных публикаций и обзоров позволили группе Европейских экспертов присвоить класс доказательности B применению низкочастотной стимуляции зоны M1 непораженного полушария у пациентов в хронической фазе инсульта (после 6 месяцев), и уровень С для высокочастотной стимуляции зоны М1 пораженного полушария, для пациентов в острой и подострой стадиях инсульта.
Афазия.
При поиске в PubMed по ключевым словам rTMS AND aphasia найдено 75 работ, большинство из которых относятся к классу IV (клинические случаи и серии случаев), а также несколько работ III класса (плацебо-контролируемые исследования). Большинство работ использует низкочастотную стимуляцию гомолога зоны Брока в правом полушарии в 45 поле по Бродману зоне Бродмана 45, нижней лобной извилины. Нейровизуализацинные исследования показывают, что повышение активации в правом гомологе зоны Брока ассоциировано с плохим прогнозом восстановления речевых функций (Saur and Hartwigsen, 2012).
Первое контролируемое исследование 2011 года включало 10 пациентов с различными формами афазии в подострой стадии инсульта (Weiduschat et al., 2011). Было показано достоверное улучшение речевых функций при низкочастотной стимуляции нижней лобной извилины правого полушария по сравнению с группой пациентов у которых проводилась стимуляция вертекса. Позднее этой же группой исследователей данные были подтверждены и доказана глобальная эффективность описанного протокола вне зависимости от формы афазии (Heiss et al., 2013; Thiel et al., 2013). В данных исследованиях сеансы стимуляции сочетались с логопедическими занятиями.
Другая группа исследователей не нашла достоверных отличий в реальной стимуляции правого полушария и его имитации (Waldowski et al., 2012; Seniów et al., 2013).
Также существует несколько работ, об использовании возбуждающих режимов стимуляции на поражённое полушарие. Szaflarski et al., 2011 на 8 пациентах с хронической постинсульной афазией показали эффективность режима iTBS с приложением к зоне Брока (навигация на максимальный воксел по фМРТ) пораженного полушария. Стимуляция нижних лобных извилин двух полушарий: низкочастотная правого и высокочастотного левого; у пациентов с хронической постинсультной афазией также показало свою эффективность в улучшении речевых функций (Khedr et al., 2014; Vuksanovic ́ et al. 2014).
Таким образом, по заключению Европейского совета экспертов в настоящее время недостаточно данных и крупных исследований для однозначного утверждения об эффективности рТМС в речевой реабилитации после инсульта. Необходимо проведение дополнительных клинических триалов.
Неглект-синдром.
Одностороннее пространственное игнорирование (неглект-синдром) встречается у 30% пациентов, перенесших инсульт, и в значительное мере ограничивает их реабилитацию. Наиболее часто поражение при неглект-синдроме располагается в правой задней теменной и верхней височной извилинах (Ellison et al., 2004). Основная терапевтическая стратегия основана на принципе конкурентного взаимодействия одноименных регионов коры обоих полушарий. При повреждении правого полушария (теменно-височных отделов) возникает гиперактивация в одноименных отделах левого полушария. Таким образом. ингибирование данных отелов низкочастотной или сTBS стимуляцией является предпочтительным методом в коррекции неглект-синдрома. С другой стороны, возможно повышение возбудимости пораженных отелов с помощью высокочастотной стимуляции и iTBS режима.
Большинство работ посвящено использованию ингибирующих режимов. 4 исследования оценивали эффективность 10-и дневного курса низкочастотной стимуляции левой теменной коры (Brighina et al., 2003; Shindo et al., 2006; Song et al., 2009; Lim et al., 2010). Во всех исследованиях отмечен положительный эффект, но ни одно из приведенных исследований не включало группу имитации стимуляции. Только одно плацебо-контролируемое исследование было проведено в 2013 году. Исследование показало большую эффективность высокочастотной стимуляции правой теменной коры в сравнении с низкочастотной стимуляций и имитацией стимуляцией у пациентов в остром периоде инсульта (Kim et al., 2013). Отдельная группа работ посвящена ингибирующему режиму cTBS на противоположное очагу полушарие (Nyffeler et al., 2009; Cazzoli et al., 2012; Koch et al., 2012). Все 3 работы отвечают III классу исследований (рандомизированне двойные-слепые, плацебо-контролируемые) и показывают эффективность cTBS на левую заднюю теменную область в терапии неглект-синдрома. Данный эффект длиться вплоть до 3х недель после прекращения стимуляции. Описанные исследования позволили Европейской группе экспертов присвоить класс доказательности С (возможно эффективные) режиму cTBS левой задней теменной области в терапии неглект-синдрома.
Болезнь Паркинсона.
В настоящее время в базе данных PudMed найдено 159 публикаций по теме применения рТМС, как средства уменьшения симптомов Болезни Парксинсона (БП). Из них около 15 контролируемых исследований, включающих 454 пациента с БП, и 1 мета-анализ 2009 года, объединяющий 10 исследований и 275 пациентов с БП. Основной проблемой при анализе исследований пациентов с БП является сложность в подборе идентичных пациентов в группу исследования. Пациенты различаются по длительности заболевания, проводимой терапии и ответу на лечение (Lefaucheur et al., 2014).
В качестве мишеней для стимуляции в большинстве работ используется моторная (M1) и премоторная кора (PMC). В упомянутом выше мета-анализе делается вывод, что высокочастотная стимуляция этих зон (M1 и PMC) является эффективным методом улучшения моторных функции при БП по сравнению с низкочастотной стимуляцией (Elahi et al., 2009). Более того, ряд исследований отмечают ухудшение моторных функций при БП после низкочастотной стимуляции: увеличение времени выполнения задания (Sommer et al., 2002; Grüner et al., 2010), увеличение ригидности (Lefaucheur et al., 2004). Опираясь на эти данные Европейская группа экспертов не рекомендует к применению низкочастотную стимуляцию моторных зон при БП.
Что касается высокочастотной стимуляции при БП, первая работа была опубликована Pascual-Leone et al. в 1994 году, в ней на 6 пациентах с БП было показано достоверное улучшение движений после подпороговой стимуляции М1 с частотой 5 Гц. После этого, данный эффект был подтвержден в 25 независимых исследованиях, доказывающих эффективность высокочастотной рТМС на зону M1 у пациентов с БП. Основной шкалой для оценки терпевтической эффективности является часть III шкалы UPDRS, в которой, в частности, оцениваются скорость движений и ходьбы.
Данные эффекты достигаться как при стимуляции одного полушария (Siebner et al., 1999, 2000; de Groot et al., 2001; Börnke et al., 2004; Lefaucheur et al., 2004; Kim et al., 2008), так и при стимуляции с двух сторон (Khedr et al., 2003, 2006, 2007; González- Garcıá et al., 2011). Наряду с позитивными результатами об использовании высокочастотной рТМС при БП, есть ряд работ, закончившихся негативными результатами (Rothkegel et al., 2009; Sedlácková et al., 2009; Benninger et al., 2011, 2012). Наличие отрицательных данных не позволили Европейской группе экспертов сделать заключение об однозначной эффективности высокочастотной односторонней стимуляции при БП с применение 8-образной катушки (Lefaucheur et al., 2014).
В этой связи особый интерес представляют работы, касающиеся стимуляции обоих полушарий и с применение круглых и H-койлов, стимулирующих большую зону мозга, но менее локально. Так в последней работе 2013 года показано, что двусторонняя высокочастотная стимуляция М1 представительства нижних конечностей достоверно увеличивает скорость ходьбы (Maruo et al., 2013). В другом исследовании 2014 года, показано достоверное улучшение моторных функций по шкале UPDRS-III (среднее снижение на 11 баллов) у 27 пациентов с БП после 12 сессий высокочастотной (10 Гц) рТМС с двух сторон с применением H-койла на зоны M1 и DLPFC (Spagnolo et al., 2014).
Что касается других мишеней для стимуляции, у пациентов с БП также применялась стимуляция на премоторную кору (PMC) и дополнительную моторную кору (SMA). Для SMA данные являются противоречивыми. В ряде исследований показано, что высокочастотная стимуляция этой зоны не оказывает достоверных эффектов (Shirota et al., 2013) или оказывает отрицательное воздействие на моторные функции (Boylan et al. (2001). Тем не менее, японское рандомизированное слепое контролируемое исследование (класс исследования 1) показало, что низкочастотная (1 Гц) стимуляция SMA приводит к достоверному улучшению моторных функций при БП (6,8 баллов по шкале UPDRS-III), но не влияет на не моторные симптомы болезни. Стоит отметить, что низкочастотная стимуляция SMA также эффективна при леводопа-индуцированной брадикинезии (Koch et al., 2005; Brusa et al., 2006).
Как высокочастотная, так и низкочастотная стимуляция PMC не привела к достоверным улучшениям моторных функций при БП, поэтому она не может рекомендоваться как мишень для терапевтической стимуляции при БП (Sedlácková et al., 2009; Bäumer et al., 2009).
На основании проанализированных публикаций можно сделать заключение, что возможный антипаркинсонический эффект показан для высокочастотной стимуляции зоны М1, предпочтительнее с двух сторон и койлами с увеличенной зоной стимуляции (круглые, H-койлы). Тем, не менее, с учетом противоречивых данных, для присвоения класса доказательности необходимо проведение дополнительных крупных исследований с хорошим дизайном.
Фокальные дистонии (писчий спазм, блефароспазм).
Большинство опубликованных в настоящее время исследования, посвященные лечению дистонию с помощью рТМС, связаны с применением низкочастотных протоколов, направленных на зоны М1, PMC, S1, цингулярная извилина. В базе данных Pubmed в настоящее время определяется 44 публикации, посвященные использованию рТМС при различных формах дистонии. Тем не менее, все публикации являются довольно разноплановыми, трудно сопоставимыми и с малым числом пациентов.
Низкочастотная стимуляция зоны M1 у пациентов с писчим спазмом показывает разнонаправленные данные (Siebner et al., 1999; Murase et al., 2005). Большинство исследований показали эффективность низкочастотной стимуляции PMC в терапии писчего спазма, в частности, показано достоверное улучшение точности и скорости выполнения движений. Тем не менее, по мнению Европейских экспертов, приведенные данные не могут служить основанием для подтверждения эффективности данного протокола при дистонии, так как исследования включали гетерогенные группы пациентов и применялись не одинаковые протоколы стимуляции.
В 2010 году проведено исследование (класс III), рассматривающее еще один регион для стимуляции при дистонии – первичную сенсорную зону. У пациентов с писчим спазмом показано достоверное улучшение моторных функций после однократной сессии низкочастоной стимуляции достоверные улучшения моторных функций в пораженное руке (Havrankova et al., 2010). У пациентов с блефароспазмом выявлено клиническое улучшение после низкочастотной стимуляции передней цинггулярной коры с помощью круглого или H-койла (Kranz et al., 2010). Однако, это исследование имеет ряд серьезных методологических вопросов и должно быть продублировано независимой группой ученых.
Таким образом, для фокальной дистонии наиболее доказанным протоколом является низкочастотная стимуляция премотрной зоны коры, но для уточнения степени доказательности необходимо проведение дополнительных крупномасштабных исследований.
Болевые синдромы.
Хронические болевые синдромы – достаточно распространенная проблема в мировом здравоохранении. Согласно статистическим данным до половины всего взрослого населения когда-либо испытывали болевой синдром длительностью более 3 месяцев, при этом от 10 до 20% пациентов страдают от клинически значимой боли. Хроническая боль с элементами нейропатической встречается у 6-8% взрослого населения (Torrance et al., 2006; Bouhassira et al., 2008) Только у 30-40% больных проводимая фармакотерапия позволяет достичь достаточного обезболивающего эффекта (снижение выраженности болевого синдрома не менее, чем на 50% по ВАШ) (Cruccu et al., 2006).
В 1991 г. Tsubokawa et al. впервые показали, что эпидуральная стимуляция головного мозга эффективно уменьшает боль у пациентов с таламическим синдромом (Tsubokawa et al., 1991) . Позднее та же группа показала, что наиболее эффективно ингибирование происходит при стимуляции первичной моторной коры. Мета-анализ различных исследований эффективности стимуляции моторной коры показал, что 64% пациентов с различными типами нейропатической боли отмечают достоверное уменьшение болевого синдрома после процедуры. (Lima, Fregni, 2008).
Эффективное использование инвазивной стимуляции моторной коры для лечения хронических болевых синдромов стало предпосылкой к поиску менее инвазивных методов, позволяющих с достаточным пространственным разрешением, то есть достаточно локально, стимулировать вышеуказанные участки коры большого мозга. Одной из таких методик стала транскраниальная магнитная стимуляция.
рТМС в лечении хронической нейропатической боли
В базе данных Pubmed насчитывается 68 публикаций, включая 19 плацебо-контролируемых исследований.
В 6 исследованиях класса II-III (Lefaucheur et al., 2001, 2006, 2008; André-Obadia et al., 2006; Irlbacher et al., 2006; Saitoh et al., 2007), с общим количеством пациентов 138, продемонстрировано отсутствие достоверного обезболивающего эффекта при низкочастотной стимуляции первичной моторной коры полушария, противоположного локализации боли. Таким образом, низкочастотная рТМС по мнению Европейской группы экспертов неэффективна в лечении хронических нейропатических болей (уровень доказательности В).
С 2001 г. было проведено 20 исследований с общим числом пациентов 501, в которых оценивалась эффективность высокочастотной рТМС в терапии хронических болевых синдромов различного генеза. В трех исследованиях, в которые было суммарно включено 50 пациентов, показана неэффективность высокочастотной рТМС (Irlbacher et al., 2006; André-Obadia et al., 2006; Kang et al., 2009). Однако, стоит отметить методологические недостатки в дизайне, рандомизации, небольшой размер выборки в данных исследованиях. Отрицательные результаты, кроме того, были получены при высокочастотной стимуляции моторной коры круглой катушкой, что, наиболее вероятно, связано с менее локальным воздействием (Rollnik et al., 2002).
В остальных исследованиях была показана эффективность высокочастотной рТМС по сравнению с имитацией стимуляции. При этом, в некоторых работах проводился только один сеанс рТМС и оценка обезболивающего действия проводилась непосредственно после стимуляции (Lefaucheur et al., 2001a, b; 2004; 2006; 2008; 2011; Andre-Obadia et al., 2011; 2014; Hirayama et al., 2006; Jette et al., 2013; Saitoh et al., 2007). Однако, более важным является оценка долговременных эффектов рТМС, возникающих после проведения нескольких сеансов. В данных исследований был продемонстрирован долговременный обезболивающий эффект при хронических нейропатических болях различной этиологии (Khedr et al, 2005; Hosomi et al., 2013), а также при фантомных болях (Ahmed et al, 2011).
Опубликовано несколько системных обзоров и мета-анализов исследований эффективности рТМС в лечении хронического болевого синдрома. (Cruccu et al, 2007; Lefaucheur et al., 2008; Leo et al., 2007; Leung et al., 2009; O'Connell et al., 201; O'Connell et al., 2011). В них указывается на неэффективность низкочастотной рТМС и эффективность высокочастотной рТМС (уменьшение боли >30% у 46-62% пациентов и >50% у 29% пациентов), возможность получения умеренного долговременного эффекта при использовании протоколов с несколькими сеансами рТМС. В мета-анализ Leung et al, 2009 вошли данные 5 исследований, общее количество пациентов – 149. Исследовалась эффективность рТМС при невралгии тройничного нерва, центральном постинсультном болевом синдроме, травме спинного мозга, повреждении нервного корешка или периферических нервов. В качестве оценки эффективности терапии использовалось снижение интенсивности болевого синдрома по визуальной аналоговой шкале (ВАШ). Как при оценке в целом, так и при разделении на группы в зависимости от этиологии болевого синдрома, отмечено достоверное снижение болевого синдрома у пациентов, получавших рТМС по сравнению с имитацией стимуляции. При этом наибольший анальгетический эффект отмечался у пациентов с невралгией тройничного нерва (28.8%), далее у пациентов с центральным постинсультным болевым синдромом (16,7%), травмой спинного мозга (14,7%), повреждением нервного корешка (10,0%) и периферического нерва (1,5%). Кроме того, показано, что наибольшим эффект достигается при большем количестве сессий (по сравнению с одной) и при частоте стимуляции от 1 до 10 Гц. рТМС более эффективна в лечении центральной нейропатической боли, нежели периферической.
Кроме того, использование других протоколов, оказывающих возбуждающее действие (например, интермиттирующие тета-вспышки (iTBS)), не показало свою эффективность кроме одного исследования, где показано, что использование комбинированного протокола, в котором стимуляция тета-вспышками предшествовала проведению высокочастотной рТМС более эффективно по сравнению с высокочастотной стимуляцией (Lefaucheur et al., 2012)
Таким образом, согласно приведенным публикациям и мнению Европейского совета экспертов, высокочастотная рТМС первичной моторной коры (М1) контралатерального области боли полушария может быть рекомендована как эффективный метод терапии (уровень доказательности А).
Однако не только первичная моторная кора может служить мишенью для стимуляции. Опубликовано 2 пилотных исследования, подтверждающих эффективность низкочастотной стимуляции правой дорсолатеральной префронтальной коры и высокочастотной стимуляции левой дорсолатеральной коры (протоколы, применяемые для лечения депрессии) в лечении хронических нейропатических болей, при этом данные эффекты не зависели от изменений настроения. (Borckardt et al., 2009; Sampson et al., 2011). Небольшое количество пациентов (суммарно 13 в обоих исследованиях) не позволяет рекомендовать стимуляцию данных зон для лечения, необходимо проведение более мощных исследований. В исследованиях Hirayama et al, 2006, Saitoh et al, 2006 показана неэффективность рТМС первичной сенсорной коры, премоторной коры (PMC), дополнительной моторной коры (SMA) в лечении хронических нейропатических болей.
Мигрень
Исследований, посвященных использованию рТМС в лечении мигрени не так многочисленны, кроме того, во многих из них для оценки использованы различные нейрофизиологические, но не клинические параметры. (Bohotin et al., 2002; Brighina et al., 2002, 2005, 2010; Fierro et al., 2003; Fumal et al., 2006; Conte et al., 2010). Три исследования, в которых мишенью для стимуляции служила левая дорсолатеральная префронтальная кора (ДЛПФК) были проведена на малом количестве пациентов (суммарно 24 человека) и показали противоречивые результаты. В 2013 г. Misra et al опубликовано слепое рандомизированное плацебо-контролируемое исследование эффективности рТМС зоны руки первичной моторной коры слева в лечении мигрени. В исследование включено 100 пациентов, проводилось 3 сеанса рТМС с частотой 10 Гц, интенсивностью 70% моторного порога покоя. В группе активной стимуляции показано уменьшение частоты, интенсивности болей, степени инвалидизации пациентов. Клиническое улучшение связывалось с повышением уровня β-эндорфина в плазме крови. Кроме того, проводилось исследование эффективности низкочастотной рТМС вертекса с использованием круглой катушки, показана неэффективность данного протокола. Однако, учитывая отсутствие воспроизводимых контролируемых исследований с большим количество пациентов, ни один из вышеуказанных протоколов не может быть рекомендован как эффективный в лечении мигрени.
Кроме того, Lipton et al., 2010 показали эффективность транскраниальной магнитной стимуляции затылочных долей одиночными стимулами для купировании мигренозного приступа, сопровождающегося зрительной аурой. Было разработано портативное устройства, одобренное для клинического применения FDA в 2014 г.
Комплексный регионарный синдром I типа.
Комплексный регионарный болевой синдром (КРБС) объединяет чувствительные, двигательные и вегетативно-трофические расстройства, которые ранее описывались под названием «рефлекторная симпатическая дистрофия» и «каузалгия». КРБС I типа обычно развивается после микротравмы или воздействия в форме длительной иммобилизации (наложение лонгеты, гипса, yшиба, травма мягких тканей конечности и др.). Основные проявления КРБС, лежащие в основе диагностических критериев, заключаются в развитии в пределах одной конечности (чаще в дистальных ее отделах) болевого синдрома: жжение, ноющие или ломящие боли в сочетании с чувствительными нарушениями (гипо- или анестезией, гиперпатией, аллодинией).
Болевой синдром при КРБС по своей природе является нейропатической болью. В этой связи при данном состоянии рТМС может рассматриваться как эффективный метод терапии.
В рамках данной патологии проведено 2 рандомизированных плацебо-контролируемых исследования эффективности рТМС первичной моторной коры в лечении КРБС I типа (Pleger et al., 2004; Picarelli et al., 2010). В исследования вошло 32 пациента. В обоих исследованиях показано достоверное уменьшение болевого синдрома непосредственно после сеанса рТМС, однако большая вариабельность длительности долговременного эффекта. Учитывая результаты приведенных выше исследований, высокочастотная рТМС М1 может быть рекомендована как возможная терапия КРБС I типа (уровень доказательности С).
Фибромиалгия
У пациентов с фибромиалгией исследовалась эффективность рТМС первичной моторной коры и дорсолатеральной префронатальной коры. Sampson et al. в 2006 году проведено открытое исследование (Класс IV), в котором показана эффективность низкочастотной рТМС правой дорсолатеральной префронтальной коры у 4 пациентов, страдающих фибромиалгией (Sampson et al., 2006). Однако в исследовании схожего дизайна Carretero et al, 2009 были получены отрицательные результаты, возможно, из-за малого количества стимулов в течение одной сессии (400/сессию). В исследовании Short et al. на 20 пациентах с фибромиалгией продемонстрировано достоверное уменьшение болевого синдрома после 10 сеансов высокочастотной стимуляции левой дорсолатеральной префронтальной коры по сравнению с группой имитации стимуляции.
Passard et al в 2007 проведено двойное слепое рандомизированное плацебо-контролируемое исследование, в котором показано достоверное уменьшение болевого синдрома и улучшение качества жизни, сохранявшееся в течение месяца в группе пациентов, получавших 10 сеансов высокочастотной стимуляции первичной моторной коры по сравнению с имитацией стимуляции. Той же группой в 2011 проведено исследование с использованием высокочастотной стимуляции М1, подтвердившее предыдущие результаты, кроме того, для увеличения длительности долговременного обезболивающего эффекта предложено использовать «поддерживающие» сессии рТМС (Mhalla et al., 2011). Однако, эффективность стимуляции первичной моторной коры не подтверждена исследованиями, проведенными другими группами. Таким образом, учитывая неоднозначные результаты исследований, на настоящий момент нельзя рекомендовать ни один из протоколов рТМС для лечения фибромиалгии.
До сих пор остается не до конца ясным механизм воздействия рТМС при хронических нейропатических болях. Существует несколько гипотез. Согласно одной из них, эффекты стимуляции моторной коры опосредованы воздействием на проекции М1 на структуры, участвующие в формировании болевого восприятия, среди которых медиальные отделы таламуса, передняя цингулярная борозда, орбитофронтальная кора, околоводопроводное серое вещество. (Wasserman et al., 2008.) Согласно другой, обезболивающее действия рТМС является следствием стимуляции ГАМК-эргических тормозных нейронов моторной коры, которые напрямую ингибируют активность ядер таламуса, блокируя таким образом всю соматосенсорную систему, включая и ноцицепцию (Plow et al., 2012). Эту гипотезу подтверждает тот факт, что эффективность рТМС коррелирует с сохранностью таламокортикального тракта у пациентов с постинсультным болевым синдромом (Goto et al., 2008; Ohn et al., 2012).
Эпилепсия.
Как это ни странно, но стимуляция головного мозга, в некоторых случаях способная вызвать судорожный приступ, может являться и методом лечения эпилепсии. Речь идет, в первую очередь, о фармакорезистентных формах эпилепсии, которых насчитывается порядка 20% среди первично генерализованных форм и 60% среди фокальных форм (Pati and Alexopoulos, 2010).
В базе данных PubMed найдено 102 публикаций по применению рТМС при эпилепсии, из них 5 плацебо-контролируемых исследования и 1 мета-анализ 2011 года. Общее число пациентов 165. Проведенные исследования в своей массе дали противоречивые результате, включали небольшое число пациентов и были неоднородны по формам эпилепсии. Из пяти упомянутых исследованиях с плацебо группой (Theodore et al., 2002; Tergau et al., 2003; Fregni et al., 2006; Cantello et al., 2007; Sun et al., 2012), только в двух получены достоверные данные о снижении частоты приступов по сравнению с группой плацебо (Fregni et al., 2006; Sun et al., 2012).
В мета-анализе 2011 года (Hsu et al., 2011), включившем 11 контролируемых исследования с общим охватом 164 пациента, был сделан вывод о достоверном снижении частоты приступов при низкочастотной стимуляции эпилептического фокуса, при неокортикальных эпилепсиях и корковых дисплазиях.
Опубликованные в настоящее время данные, с учетом всех ограничений позволили Европейской группе экспертов присвоить класс доказательности С (вероятно эффективный) низкочастотному режиму стимуляции эпилептического фокуса при его расположении в коре или в непосредственной близости от корковой дисплазии.
В завершении этого раздела стоит напомнить, что одним из принципов лечения эпилепсии является непрерывность и в случае с медикаментозной терапией, нерегулярные прием препаратов может вызвать ухудшение течения заболевания, даже эпилептический статус. В случае с рТМС кратность сеансов стимуляции всегда ограничена, а долговременные эффекты рТМС, как правило, не превышает 3х месяцев. Таким образом, следует с осторожностью применять рТМС при эпилепсии и проводить лечение под контролем эпилептолога.
Тиннит.
Тиннит (шум в ухе) – это ощущение звука любой частоты в ухе или в голове в отсутствие внешнего звукового стимула. Этот шум субъективен, то есть воспринимается только пациентом. Распространенность тиннита достаточно велика и составляет около 10-15% во взрослой популяции (Davis, Rafaie, 2000; Khedr, 2010). При этом 1,6% пациентов описывают шум в ушах как тяжелый, 2,8% как умеренный, однако только 0,5% как оказывающий сильное влияние на привычный образ жизни. Распространенность тиннита не зависит от пола (Davis, Rafaie, 2000).
До настоящего времени четкой гипотезы о причинах и патофизиологических механизмах развития тиннита нет. Учитывая тот факт, что снижение слуха является главным фактором риска развития тиннита, считается, что слуховые фантомные ощущения могут быть проявлением нейропластического ответа на сенсорную депривацию (Eggermont, Roberts, 2004). Согласно последним исследованиям с использованием функциональной магнитно-резонансной томографии (фМРТ) и позитронно-эмиссионной томографии (ПЭТ) предполагается, что в возникновении звуковых ощущений и их осознанном восприятии принимает участие нейронная сеть, состоящая не только из первичной слуховой коры, но также теменных и лобных областей, элементов лимбической системы.(De Ridder et al., 2011) К настоящему времени не существует методов лечения тиннита, эффективных у всех пациентов. рТМС является кандидатом на роль в лечении тиннита, в первую очередь из-за её возможности избирательно усиливать или подавлять активность определенных участков коры головного мозга, влияя напрямую или опосредованно на восприятие звуков. Результаты нейровизуализационных исследований позволили предположить возможность подавления избыточной активности первичной слуховой коры и других зон, ассоциированных с возникновением тиннита.
Было проведено несколько исследований эффективности рТМС в лечении тиннита. В базе данный PubMed найдено 111 статей, включающих 20 плацебо-контролируемых исследований. Общий охват 601 пациент.
В исследовании Anders 2010 (Anders et al., 2010) проводилась низкочастотная (1 Гц) стимуляция первичной слуховой коры у 42 пациентов с фармакорезистентным тиннитом. В группе активной стимуляции отмечалось достоверное уменьшение баллов по опроснику тиннита (Tinnitus questionare) через 2, 6, 14 недель после стимуляции, тогда как в группе имитации стимуляции подобные изменения регистрировались только через 2 недели. В исследовании Marcondes RA et al., 2010 также показана эффективность низкочастотной рТМС верхней височной коры в терапии тиннита по сравнению с имитацией стимуляции, причем длительность эффекта составляла как минимум 6 месяцев. В исследовании Khedr EM et al, 2008 проводилось сравнение различных протоколов стимуляции (1 Гц, 5 Гц, 25 Гц) левой височно-теменной коры. Не было получено достоверных различий в эффективности в разных группах, степень эффективности рТМС отрицательно коррелировала с длительностью тиннита у пациентов.
В систематическом обзоре Z Meng et al, 2011 проанализировано 5 крупных исследований, в которые вошли 233 пациента. Только в одном исследовании показана эффективность низкочастотной рТМС по сравнению имитацией стимуляции в улучшении качества жизни пациентов с тиннитом, в других исследованиях статистически достоверных различий получено не было. В двух исследованиях показано достоверное снижение громкости шума, однако суммарное количество пациентов в этих исследованиях невелико. В одном исследовании была показана частичная эффективность низкочастотной стимуляции по сравнению с высокочастотной и имитацией длительностью до 4-х месяцев. Ни в одном из перечисленных исследований не сообщалось о выраженных побочных эффектах стимуляции.
Таким образом, исследования подтверждают безопасность рТМС для лечения тиннита на протяжении короткого времени наблюдения, однако для оценки долговременной безопасности данных исследований недостаточно. Согласно мнению Европейской группы экспертов, низкочастотная ритмическая транскраниальная магнитная стимуляция первичной слуховой коры может быть использована в качестве альтернативной терапии шума в ушах (терапии 2 линии) (уровень доказательности С), однако, требуются проведение новых крупных двойных слепых рандомизированных плацебо-контролируемых исследований для разработки более четких критериев отбора пациентов в целях повышения эффективности лечения.
Спастичнось.
Общепринятое определение спастичности дано Ланцем в 1980 году (Lance J.W., 1980] - «двигательное нарушение, являющееся частью синдрома поражения верхнего мотонейрона, характеризующееся скорость-зависимым повышением мышечного тонуса и сопровождающееся повышением сухожильных рефлексов в результате гипервозбудимости рецепторов растяжения».
В настоящее время для лечения спастичности преимущественно используется медикаментозная терапия. Однако лекарственные препараты часто не оказывают должного клинического эффекта, но вызывают различные побочные реакции.
Транскраниальная магнитная стимуляция (ТМС) в данном случае может является альтернативным методом.
Основной концепцией рТМС при спастичности является повышение возбудимости коры высокочастотными и iTBS режимами. За счет активации коры, усиливается нисходящее влияния на спинальную рефлекторную активность, увеличивается тормозное влияние на чрезмерно возбужденные альфа-мотонейроны и в конечном итоге происходит к снижению рефлекса растяжения и спастичности.
В базе данных PubMed найдено 16 опубликованных исследований по изучению влияния ТМС на спастичность.
Среди всех исследований, только 5 являются слепыми и имеют группу контроля (Centonze et al., 2007, Kumru et al., 2010,Mori et al., 2010, 2011 , Valle et al., 2007, Galvao. et al, 2008; Benito et al, 2012].
Некоторые исследования в качестве лечения использовали комбинацию различных протоколов ТМС с лечебной физкультурой (ЛФК) (Morietal., 2011, Kakuda et al., 2010, 2011, Galvão et al., 2013, Etoh et al., 2013), ТМС с функциональной нервно-мышечной стимуляцией, вызванной электромиографией (ЭНМГ-ФНМС) (Theilig et al., 2011).
Для лечения спастичности были использованы два основных протокола: iTBS (Mori et al., 2010, 2011, Chervyakov et al., 2013); высокочастотгная рТМС (Nielsen et al., 1996, Valle et al., 2007, Centonze et al., 2007, Kumru et al., 2010, Benito, 2012, Málly et al., 2007, Kakuda et al., 2011, 2010, Galvão et al., 2013, Theilig et al., 2011, Chervyakov et al., 2013, Izumi et al., 2008, Etoh et al., 2013).
ТМС для лечения постинсультной (церебральной) спастичности
Barros Galvão в 2013 г. провел рандомизированное двойное-слепое плацебо-контролируемое исследование по изучению эффективности низкочастотной стимуляции зоны M1 (1Hz) непораженного полушария. После проведения 10 сессий стимуляции и курса лечебной физкультуры (ЛФК) у 90% пациентов после окончания курса стимуляции и у 55.5% во время 4х недельного периода наблюдения отмечалось снижение показателей модифицированной шкале Ашфорта (МАШ) ≥1 балл.
В научном центре неврологии в настяощее время проводятся работы по изучению транскраниальной магнитной стимуляции в нейрореабилитации, о которым мы говорили выше. Нами было отмечено, что снижение спастичности возникает при высокочастотной стимуляции пораженного полушария.
На основании разнонаправленых данных в настоящее время нет убедительных доказательств о влиянии рТМС на симптомы церебральной спатичности. Требуется проведение дополнительных исследований.
ТМС для лечения cпинальной спастичности
Под спинальной спастичностью мы понимаем синдром, возникшей при наличии повреждения на уровне спинного мозга.
По результатам рандомизированного двойного-слепого плацебо-контролируемого исследования, проведенного Jorgen F Nielsen в 1996 г., отмечалось снижение уровня спастичности после высокочастотной (25Hz) стимуляции зоны M1 на на 18%. Стимуляция проводилась два раза в день на протяжении 7 дней.
F. Mori в 2011 провел двойное-слепое плацебо-контролируемое исследование с рандомным разделением на группы с изучением эффективности iТВS режима моторной области ноги и ЛФК на снижение спастичности у пациентов с рассеянным склерозом. В результате авторы отметили снижение уровня спастичности при проведении iТВS или комбинации ТВС и ЛФК.
В результате исследования, проведенного D. Centonze в 2007 г. было получено снижение уровня спастичности после 10 сессий высокочастотной (5Hz) стимуляции моторного представительства ноги.
В рандомизированном двойном-слепом плацебо-контролируемом исследовании, проведенном Hatice Kumru в 2010 г., было показано снижение уровня спастичности после высокочастотной стимуляции (20Hz). Стимуляция проводилась 1 раз в день на протяжении 5 последовательных дней.
Полученные данные свидетельствуют о предположительной эффективности высокочастотной стимуляции зоны М1 при наличии очага поражения на уровне спинного мозга (класс С). Тем не менее, Европейская группа экспертов считает необходимым проведение дополнительных крупных исследований для подтверждения уровня доказательности.
Депрессия.
Тревожность и депрессия рассматриваются нами в последнюю очередь, так как имеют большее отношение к психиатрии, нежили к неврологии. Хотя доказательная база эффективности рТМС при лечении данных нозологий превосходит некоторые из описанных выше состояний.
Депрессия является одним из самых распространенных психических расстройств. По оценкам Всемирной организации здравоохранения в мире от нее страдает более 350 млн человек всех возрастных групп. Распространенность депрессивных расстройств (включая униполярную депрессию, биполярные расстройства) варьирует в пределах от 3% в Японии до 16,9% в США и составляет в среднем от 8 до 12% (Andrade et al., 2003). По прогнозам, к 2020 г. депрессия станет второй по частоте причиной нетрудоспособности (WHO, 2001). Социально-экономическая значимость депрессии обусловлена также тем, что тяжелые депрессивные эпизоды являются основной причиной самоубийств, от которых ежегодно погибают до 1 млн человек. В России 6–7 % населения страдает депрессивными и тревожными расстройствами (Ротштейн В. Г и соавт., 2005).
В базе данных PubMed при поиске по ключевым словам rTMS/TBS AND depression определяется 786 публикаций, включая 61 плацебо-контролируемое исследование. Общий охват пациентов 3682 человека.
В первых исследованиях эффективности рТМС в лечении депрессии, которые начались в 90-х годах, в качестве мишени для стимуляции использовали вертекс (Hoflich G et al., 1993, Kolbinger HM et al., 1995, Grisaru N et al., 1994). Однако, в 1996 г. George MS et al (1996) в экспериментах на здоровых добровольцах показали, что стимуляция только префронтальных зон (дорсолатеральная префронтальная кора справа и слева, медиальная префронтальная кора) вызывает изменение настроения. Предполагается, что в патогенезе депрессивных расстройств играет роль нарушение взаимодействия между префронтальной корой и структурами лимбической системы (островок, поясная извилина, амигдала, гиппокамп) (George MS et al., 1994). Высокочастотная рТМС оказывает возбуждающее действие на зону стимуляции, таким образом, при стимуляции префронтальной коры возможна активизация регуляторных путей, связывающих эту область с лимбической системой. В 1997 г. на группе из 12 пациентов с фармакорезистентной депрессией была показана эффективность рТМС левой дорсолатеральной префронтальной коры по сравнению с имитацией стимуляции (George et al., 1997). Однако, несмотря на положительный результат, малое количество участников не позволяло однозначно оценивать данную методику как эффективную. Кроме того, оставались нерешенными такие вопросы, как определение зоны и частоты стимуляции, количества стимулов и длительности сессий, определение категории пациентов, которых следует подвергать данной процедуре, необходимость в применении антидепрессантов во время стимуляции. В 2007 г. были опубликованы результаты рандомизированного плацебо-контролируемого исследования, в котором принимали участие 301 пациент с резистентной депрессией без поддерживающей фармакотерапии во время стимуляции. Была показана эффективность длительной (20-30 сеансов в течение 4-6 недель) высокочастотной (10 Гц, 120% от моторного порога 3000 стимулов/ сеанс) стимуляции левой дорсолатеральной префронтальной коры (DLPFC) по сравнению с имитацией стимуляции (O'Reardon et al., 2007).
В 2008 г. управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) зарегистрировало использование данного протокола в лечении униполярного депрессивного расстройства у взрослых при отсутствии эффекта или недостаточной эффективности использования одного антидепрессанта в минимальной (или выше) терапевтической дозе и длительности в течение данного депрессивного эпизода. В России также проводились исследования по эффективности применения рТМС дорсолатеральной префронтальной коры при депрессивных расстройствах (Маслеников и соавт., 2013), в которых показана ее высокая эффективность.
В 2009 г. был опубликован мета-анализ, посвященный оценке эффективности высокочастотной стимуляции левой DLPFC в лечении депрессивных расстройств (Schutter, 2009). В данный анализ было включено 30 двойных слепых плацебо-контролируемых исследования. В эти исследования вошли 1184 пациента. Было показано, что ритмическая ТМС достоверно превосходит имитацию стимуляции в лечении депрессии.
В качестве альтернативы высокочастотной рТМС некоторыми исследователями предлагалось использовать низкочастотную стимуляцию правой DLPFC (Schlaepfer et al., 2003). Однако результаты проведенных двойных слепых плацебо-контролируемых исследований были противоречивы. В исследованиях Stern et al (2007) и Pallanti et al (2010) была показана эффективность низкочастотной рТМС правой DLPFC, то исследования Hoppner et al (2003) и Kauffmann et al (2004) не продемонстрировали достоверных различий по сравнению с имитацией стимуляции. Наиболее вероятно причиной таких различий послужила недостаточная мощность проведенных исследований (Maxwell et al., 2008).
В 2010 г. Shutter провел мета-анализ исследований эффективности низкочастотной стимуляции правой DLPFC в лечении депрессии, в котором показал, что в группе активной стимуляции наблюдается достоверное снижение баллов по классическим шкалам оценки депрессивного расстройства. В 2013 г. опубликован другой мета-анализ исследований эффективности рТМС правой DLPFC (Berlim et al., 2013), по данным которого показана эффективность данного вида стимуляции, сравнимая с использованием антидепрессантов и высокочастотной рТМС левой DLPFC, при этом суммарное число стимулов более 1200 ассоциировано с более выраженным эффектом.
На основании проведенных исследований Европейской группой экспертов установлен уровень доказательности А для высокочастатной стимуляции левой DLPFC и уровень В для низкочастотной стимуляции правой DLPFC.
Тревожное расстройство.
Тревожное расстройство в течение жизни переносят более 20% популяции (Paes F et al., 2011). Согласно данным исследования NCSR (National Comorbidity Survey Replication), проведеного в США, годичная распространенность тревожных расстройств среди общей популяции составляет 18,1 %, а пожизненная — 28,2 %, что значительно больше, чем распространенность любого другого психического расстройства (Kessler R.C et al, 2005). Однако, несмотря на существующие методы лечения (фармакотерапия, психотерапия), около 25% больных остаются резистентными к проводимой терапии (Machado S et al, 2012). Актуальности проблеме тревожных расстройств добавляет факт их высокой коморбидности с другими психическими и поведенческими расстройствами. В первую очередь речь идет о депрессии, которая в более чем половине случаев сопровождает патологическую тревогу (Kaufman J et al., 2000).
Очевидно, что необходимо искать новые альтернативные методы лечения данных состояний. Показана эффективность низкочастотной стимуляции правой дорсолатеральной префронтальной коры при генерализованном тревожном расстройстве (Bystrisky et al., 2008). При посттравматическом тревожном расстройстве высокочастотная стимуляция как левой, так и правой дорсолатеральной префронтальной коры достоверно уменьшает симптомы тревожности по сравнению с имитацией стимуляции (Boggio et al.,. 2010). Высокочастотная стимуляция левой DLPFC уменьшала симптомы обсессивно-компульсивного расстройства (Sachdev et al., 2007). Кроме того, проводились исследования эффективности рТМС при паническом расстройстве, однако достоверных различий по сравнению с группой имитации стимуляции получено не было (Prasko et al., 2007). В качестве мишени для стимуляции использовалась также первичная моторная кора и добавочная моторная кора. Mantovani et al. в 2010 показали эффективность низкочастотной стимуляции добавочной моторной коры в терапии обсессивно-компульсивного расстройства. Однако, несмотря на достаточно большое количество исследований, до сих пор остается неясным, стимуляция какой зоны и какой протокол наиболее эффективны в лечении тревожных расстройств.
Таким образом, для выработки рекомендаций по использованию ритмической ТМС в терапии тревожных расстройств необходимо проведение рандомизированных плацебо-контролируемых исследований достаточной мощности. Европейской группой экспертов признан только 1 протокол для лечения посттравматического стрессового расстройства высокочастотной стимуляции – высокочастотная стимуляция правой DLPFC (уровень С).
Обобщение.
В таблице 2 мы суммировали терапевтические протоколы рТМС, доказавшие свою эффективность в терапии и реабилитации заболеваний нервной системы, а также указали уровень доказанности этих эффектов. Стоит отметить, что при появлении новых крупных исследований, указанные ниже классы доказательности могут быть изменены
Таблица 2. Основные протоколы терапевтической ТМС.
|
Заболевание / состояние |
Протокол стимуляции с наибольшей степенью доказанной эффективности |
Уровень доказательности (Европейские рекомендации) |
|
Моторные проявления инсульта |
Низкочастотная стимуляция зоны М1 контралатерального очагу поражения полушария в остром и подостром периоде |
С (возможный эффект) |
|
Низкочастотная стимуляция зоны М1 контралатерального очагу поражения полушария в хроническом периоде |
В (вероятный эффект) |
|
|
Афазия Брока |
Низкочастотная стимуляция правой нижней лобной извилины |
Необходимо проведение дополнительных исследований |
|
Высокочастотная стимуляция левой нижней лобной извилины |
Необходимо проведение дополнительных исследований |
|
|
Афазия Вернике |
Низкочастотная стимуляция правой верхней височной извилины |
Необходимо проведение дополнительных исследований |
|
Неглект-синдром |
Режим cTBS левой (контрлатеральной) нижней теменной коры |
С (возможный эффект) |
|
Низкочастотная стимуляция (контрлатеральной) левой нижней теменной коры |
Необходимо проведение дополнительных исследований |
|
|
Болезнь Паркинсона |
Высокочастотная стимуляция зон М1 обоих полушарий |
С (возможный эффект) |
|
Дистония |
Низкочастотная стимуляция PMC, M1 или S1. |
Необходимо проведение дополнительных исследований |
|
Нейропатическая боль |
Высокочастотная стимуляция M1 противоположная стороне боли |
А (определенный эффект) |
|
Мигрень |
Высокочастотная стимуляция левой М1 или DLPFC |
Необходимо проведение дополнительных исследований |
|
Одиночные стимулы затылочной коры при начале мигренозного приступа |
Необходимо проведение дополнительных исследований |
|
|
Комплексный регионарный синдром 1 типа |
Высокочастотная стимуляция M1 противоположная стороне боли |
С (возможный эффект) |
|
Фибромиалгия |
Высокочастотная стимуляция левой М1 или DLPFC или низкочастотной стимуляция правой DLPFC |
Необходимо проведение дополнительных исследований |
|
Эпилепсия |
Низкочастотная стимуляция эпилептического фокуса |
С (возможный эффект) |
|
Тиннит |
Низкочастотная стимуляция контрлатеральной к шуму в ушах (или левой) височно-теменной коры |
С (возможный эффект) |
|
Спинальная спастичность |
Высокочастотная стимуляция зон М1 |
С (возможный эффект) |
|
Депрессия |
Высокочастотная стимуляция левой DLPFC |
А (определенный эффект) |
|
Низкочастотная стимуляция правой DLPFC |
В (вероятный эффект) |
|
|
Тревожность |
Высокочастотная стимуляция правой DLPFC при пост стрессовом тревожном расстройстве |
С (возможный эффект) |





